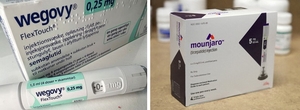
글로벌 비만치료제 시장이 본격적인 가격 경쟁 국면에 접어들면서 경쟁구도가 요동치고 있다. 상대적으로 저렴한 경구용 비만치료제 출시에 따라 향후 시장 진입을 앞둔 파이프라인의 차별성이 강조되는 한편, 전반적 제약산업 의약품 유통구조를 뒤흔들 가능성도 제기된다. 20일 한국바이오협회 등 업계에 따르면, 마운자로 개발사 일라이릴리는 지난 12일(현지시간) 미국 샌프란시스코에서 열린 'JP모건 헬스케어 컨퍼런스(JPMHC)'에서 올해 출시를 앞둔 자사 경구용 비만치료제 '오포글리프론'을 미국 식품의약국(FDA) 승인 직후 주요 글로벌 시장에 신속 출시한다는 계획을 밝혔다. 이날 일라이릴리 연구개발(R&D)·제품 총괄 책임자인 다니엘 스코브론스키는 외신 인터뷰를 통해 “(오포글리프론의) 공급은 충분한 상태로, 가능한 한 빠르게 전세계 여러 국가에서 출시할 것"이라며 “수십억달러를 투자했지만 스타벅스 커피 가격으로 (오포글리프론을) 제공할 계획이라고 말했다. 하루 5달러, 한달 149달러 수준으로 오포글리폰을 공급한다는 게 일라이릴리 측 구상이다. 앞서 노보노디스크도 지난 5일 미국 전역에 경구용 비만치료제 '위고비 필'을 저용량(1.5㎎·4㎎) 기준 월 149달러로 출시한 바 있다. 일라이릴리이의 발표로 경구용 비만치료제 가격대가 149달러 수준에서 형성됐다는 설명이다. 이는 기존 주사제 비만치료제(위고비) 판매가격인 월 350달러 대비 57.4% 낮은 수치로, 비만치료제 시장이 본격적인 가격경쟁 국면에 진입했음을 시사한다. 특히 오포글리프론의 경우, 저분자 기반 화합물로 개발돼 위고비 필 대비 공복 등 복용 제한이 적은 만큼, 환자 접근성과 복약 순응도 측면에서 강점을 확보한 것으로 평가된다. 경구용 비만치료제가 기존 주사제의 유지용법 약물로 활용되면서, 주사제 치료 수요가 경구제에 빠른 속도로 흡수될 가능성도 점쳐진다. 주사제를 통해 단기간 감량한 체중을 저렴한 경구제로 유지하고, 나아가 단기 감량 중심의 비만치료 트렌드가 장기관리 모델로 이전될 수 있다는 분석이다. 경구제 대량 생산·공급 체계를 갖춘 빅파마들의 시장 공략이 이어지는 가운데, 후발주자들이 시장 경쟁력을 확보하기 위해선 기전적 차별성과 환자 접근 전략이 필요하다는 게 업계의 시각이다. 특히 일라이릴리의 경우, 소비자 직판 플랫폼 '릴리 다이렉트'를 통해 비보험 시장 공략에 적극 나서고 있다. 이는 처방·보험 중심의 기존 제약산업 유통 트렌드가 향후 디지털 헬스케어·원격진료 등과 결합한 신규모델로 변화할 가능성을 시사하고 있다. 한국바이오협회 관계자는 “오포글리프론의 등장은 비만치료제 시장의 경쟁구도를 넘어, 정책·보험체계와 연구개발 전략, 제약산업의 유통구조 전반에 변화를 촉발할 가능성이 높다"며 “올해 FDA 승인과 출시가 현실화할 경우 비만치료는 고가 혁신치료제 중심의 제한적 시장에서 대중적이고 장기관리 중심의 영역으로 이동하며 정책·산업적 대응이 본격적으로 요구될 것"이라고 전망했다. 박주성 기자 wn107@ekn.kr












![[특징주] LS, 에식스솔루션즈 상장 철회...↑](http://www.ekn.kr/mnt/thum/202601/news-p.v1.20260126.d253c0dd89af4ebda0a340857acb25ba_T1.png)




![[초혁신기업] SKT, 통신 공룡에서 ‘AI 공룡’으로 진화 빨라진다](http://www.ekn.kr/mnt/thum/202601/news-p.v1.20260124.4051a983bc794aca993583dcb2d706c7_T1.png)


![[김성우 시평] 주식과 AI vs 기후변화](http://www.ekn.kr/mnt/thum/202601/news-p.v1.20240324.49bb7f903a5147c4bf86c08e13851edc_T1.jpg)
![[EE칼럼] 기후위기라는 ‘면죄부’를 거둘 때](http://www.ekn.kr/mnt/thum/202601/news-a.v1.20260122.91f4afa2bab34f3e80a5e3b98f5b5818_T1.jpg)
![[신연수 칼럼] AI시대, 기대와 두려움](http://www.ekn.kr/mnt/thum/202601/news-p.v1.20260113.47caa33dc5484fe5b7e3fab7e905ad16_T1.jpg)
![[이슈&인사이트] 영화관은 영화의 필요충분조건이 아니다](http://www.ekn.kr/mnt/thum/202601/news-a.v1.20260122.4f6133555bb040a6bbb4b6aee5758fda_T1.jpg)
![[데스크 칼럼] 쿠팡 길들이기, 규제보단 경쟁 강화로](http://www.ekn.kr/mnt/thum/202601/news-p.v1.20260118.8036697f3b2544f299a9ef5d3817f63c_T1.jpg)
![[기자의 눈] 현대차 노조 ‘로봇 러다이트’, 자충수될 수 있다](http://www.ekn.kr/mnt/thum/202601/news-p.v1.20260123.8f36ec05ed384c978080912f96c2eb0a_T1.jpg)





















