
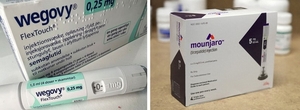
한미약품이 지난해 차세대 삼중작용 비만치료제 'HM15275'의 글로벌 임상 2상에 진입한 이후 첫 환자 투약을 완료하며 임상개발 속도를 올렸다. 한미약품은 지난해 9월 미국 식품의약국(FDA)으로부터 HM15275의 임상 2상 시험계획(IND)를 승인받은 이후 석 달여 만에 첫 환자 투약을 마쳤다고 2일 밝혔다. HM15275는 한미약품의 인크레틴 연구 노하우를 바탕으로 글루카곤유사펩타이드-1(GLP-1)과 위 억제 펩타이드(GIP), 글루카곤(GCG) 등 각각의 수용체 작용을 최적화해 비만을 비롯한 다수 대사성 질환에 효력을 볼 수 있도록 정밀 설계된 것이 특징이다. 특히 25%에 이르는 체중 감소율로 위 절제 수술을 능가하는 효과를 지향하면서도, 신체의 대사 최적화 기전을 통해 근 손실을 최소화함으로써 체중 감소의 양적·질적 개선을 동시 겨냥한다. 현재 GLP-1 기반 약물인 세마글루타이드(위고비)와 터제파타이드(마운자로)는 비만치료 임상에서 약 15~20%의 체중 감량 효과가 확인됐지만, 비만대사 수술 수준의 체중 감량(25~30%)에는 도달하지 못한다는 점에서 의학적 미충족 수요가 존재한다. 한미약품은 이번 임상 2상을 통해 36주간 장기 투여 시 비만, 고도비만 환자의 체중을 줄이고 제지방을 개선하는 차별화된 효능을 집중적으로 검증한다. 임상 개시 이후 환자 등록이 원활하게 이뤄지고 있으며, 향후 시험 대상자 모집에도 탄력이 붙어 전반적인 임상 진행 속도가 한층 가속화될 것으로 예상된다는 게 한미약품 측 설명이다. 임상 2상 종료 예상 시점은 2027년 상반기로, 한미약품은 2030년 상용화를 목표로 임상 개발을 속도감 있게 추진해 나간다는 계획이다. 이와 함께 HM15275의 적응증을 비만에서 당뇨병 치료 영역으로 확대하는 임상도 전개된다. 한미약품은 지난 달 2일 FDA로부터 당뇨병 환자 대상으로 혈당 조절 효능 등을 평가하는 임상 2상 IND 승인을 획득했으며, 해당 임상을 올해 상반기 내 개시한다는 목표다. 박재현 한미약품 대표이사는 “차세대 비만치료 삼중작용제 HM15275의 임상 2상은 FDA 제출 이후 첫 투약까지 비교적 짧은 기간 내에 속도감 있게 이뤄졌다"며 “한미 고유의 창조적 힘과 차별화된 R&D 기술 경쟁력을 토대로 신약 개발 속도를 더욱 끌어올려 '글로벌 톱티어 기업'으로 우뚝 서겠다"고 말했다. 박주성 기자 wn107@ekn.kr
2026-02-02 15:56 박주성 기자 wn107@ekn.kr











![[은행권 풍향계] 하나은행 “AI·SW 기업 ESG경영 확산 위해 금융연계 지원” 外](http://www.ekn.kr/mnt/thum/202602/news-p.v1.20260211.a209270f7c384bcc9c922fff465912b8_T1.png)





![[EE칼럼] 재활용 빙자 시멘트공장으로 몰리는 수도권 쓰레기](http://www.ekn.kr/mnt/thum/202602/news-a.v1.20260209.dc28707ca84d422abf5f49c702228375_T1.jpg)
![[EE칼럼] 미국 철강산업 귀환과 신뢰성 위기](http://www.ekn.kr/mnt/thum/202602/news-p.v1.20250702.05b45b3b37754bef91670415ae38a4b8_T1.jpg)

![[이슈&인사이트] 비트코인, ‘21세기 로마 금화’가 될 수 있는가](http://www.ekn.kr/mnt/thum/202602/news-p.v1.20240325.a19a6b33fb5c449cadf8022f722d7923_T1.jpg)
![[데스크 칼럼] 금융감독, 다시 원칙의 문제](http://www.ekn.kr/mnt/thum/202602/news-p.v1.20260208.2c5e7dfcbc68439ebd259a53d65b8d9a_T1.jpeg)
![[기자의 눈] 주식 거래시간 연장, ‘속도’보다 ‘정교함’이 먼저다](http://www.ekn.kr/mnt/thum/202602/news-p.v1.20260210.6d4994785a274e12a8b56dc146bb1f5e_T1.jpg)

































